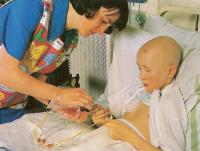
Поддерживающее лечение необходимо для компенсации недостаточности функции костного мозга, неспособного к продукции нормальных элементов крови.
Оно представлено преимущественно внутривенными вливаниями и требует частого мониторинга клинической ситуации.
Обычно сначала имплантируется постоянный внутривенный катетер (линия Хикмана), проходящий под кожей расстояние в несколько дюймов до места впадения в крупную вену на плече или шее. Он вдевается в крупнейшую центральную вену над сердцем (верхняя полая вена). Когда катетер не используется, его конец закрывается и заполняется раствором с антикоагулянтом для профилактики образования тромба.
Это дает легкий доступ к кровеносному руслу пациента, и при необходимости катетер может стоять более года. Через него же вводятся химиотерапевтические препараты.
Причины острого лейкоза
В большинстве случаев причина остается неизвестной, но возможны следующие факторы:
- В подавляющем числе случаев наблюдается разрушение ДНК лейкоцитов, однако причина этого часто неизвестна.
- У некоторых детей с врожденными заболеваниями хромосом, такими как синдром Дауна, повышен риск развития острого лейкоза.
- Превентивная противораковая химиотерапия может повредить ДНК нормальных лейкоцитов и стать предпосылкой для развития острого лейкоза.
- Это в особенности относится к алкилирующим препаратам и к сочетанию химиотерапии с лучевой терапией.
- Облучение также предрасполагает к развитию острого лейкоза. Наблюдалось увеличение числа случаев в зоне Чернобыльской аварии. До разработки стандартов рентгенологической безопасности острый лейкоз часто регистрировался у рентгенологов.
- У собак и кошек лейкоз передается через вирус. У человека очень редкий тип лейкоза вызывается вирусом HTLV-1 (вирус Т-клеточной лимфомы человека), встречающимся в южных районах Японии и странах Карибского бассейна.
- Иногда регистрируются вспышки лейкоза, особенно лимфобластного. Так, повышение частоты острых лейкозов было зафиксировано на британском ядерном перерабатывающем заводе Селлафилд, что считают связанным с местным облучением. Подобные очаги повышения частоты острых лейкозов обнаруживаются по всему миру и, возможно, обусловлены неизвестными факторами окружающей среды или инфекционными агентами.
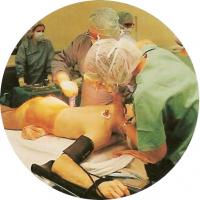
Трансплантация костного мозга
В ходе подготовки к трансплантации костного мозга от донора костный мозг пациента уничтожается мощной химиотерапией и облучением. Такие меры убивают лейкозные клетки в костном мозге. Кроме того, иммунная система, переносимая от донора, часто способна распознавать лейкозные клетки и уничтожать их - так называемый эффект «трансплантат против лейкоза». Обратной стороной процедуры является вероятность борьбы клеток донора против тканей реципиента, то есть реакции «трансплантат против хозяина».
Преимущественно поражаются кожа, кишечник и печень, в меньшей степени - все остальные органы. Костный мозг донора вводится реципиенту внутривенно. Необходимо 3-4 недели, чтобы новые стволовые клетки выросли и восстановили нормальное число клеток крови. В этот период у реципиента возникают инфекции и кровотечения, обусловленные низким количеством форменных элементов крови. Иногда костный мозг не восстанавливается из-за недостаточности трансплантата.
Таким образом, этот вариант лечения остается только для случаев рецидивов после стандартной химиотерапии или случаев, когда химиотерапия не дает эффекта. Трансплантация костного мозга редко выполняется в возрасте старше 50 лет, так как пожилые пациенты очень плохо переносят подобное лечение.
Химиотерапия
Химиотерапия направлена на селективное уничтожение злокачественных лейкозных клеток и восстановление нормальной структуры костного мозга.
Цель химиотерапии заключается в уничтожении лейкозных клеток, что обеспечивает восстановление нормального клеточного состава костного мозга. Химиотерапевтические лечение проходит в три этапа: индукция, консолидация и поддержание.
Индукция
Сначала проводится индукционная химиотерапия. После нее в костном мозге перестают обнаруживаться лейкозные клетки и восстанавливаются нормальные показатели крови. Этой терапии недостаточно для излечения от острого лейкоза, так как по опыту известно, что остаточные лейкозные клетки, невидимые в небольшом образце костного мозга, становятся причиной рецидива заболевания.
Консолидация
Для профилактики рецидива назначаются дополнительные курсы консолидационной химиотерапии. Это лечение обычно продолжается несколько месяцев.
Поддержание
Доказано, что, в отличие от миелобластного лейкоза, при остром лимфобластном лейкозе необходима поддерживающая химиотерапия. Данная химиотерапия назначается в сниженных дозах, чтобы не вызывать слишком сильного падения числа клеток крови, и может проводиться амбулаторно. У большинства детей с острым лимфобластным лейкозом химиотерапия продолжается суммарно 2 года, из которых 18 месяцев занимает поддерживающая химиотерапия.
Химиотерапевтические препараты, используемые для лечения острого лейкоза, представляют собой смесь противораковых веществ, подобных тем, что применяются при других злокачественных заболеваниях. Несколько препаратов назначается с целью увеличения шансов уничтожения лейкозных клеток, так как препараты воздействуют на различные этапы клеточного метаболизма. Кроме того, сочетание препаратов позволяет уменьшить выраженность побочных эффектов от каждого от них, так как доза отдельных препаратов снижается. Рецепт каждой химиотерапевтической смеси определяется в ходе постоянно проводимых международных исследований, когда сравниваются две похожих смеси. Это позволяет достичь наилучшего результата, который можно будет сравнивать с новыми комбинациями.
Побочные эффекты препаратов
Большинство распространенных ци-тотоксических препаратов обладает сходными побочными эффектами:
Тошнота и рвота. К счастью, открытие новых проти-ворвотных препаратов, таких как ондасентрон, позволяет в большинстве случаев купировать данные эффекты.
Алопеция (выпадение волос) и нарушение роста ногтей. Благодаря современной моде на короткие стрижки этот побочный эффект легче переносится, чем раньше. Существуют различные стратегии для уменьшения выпадения волос, такие как охлаждение кожи головы пакетами со льдом, хотя действенность этих мер сомнительна. Волосы после завершения химиотерапии вырастают, а на период лечения можно приобрести парик. Нарушение роста ногтей сопровождается образованием на них бугорков - они возникают постепенно, начиная от оснований ногтей.
Снижение числа клеток крови. Поначалу после химиотерапии число клеток крови может снизиться. В этих случаях назначается поддерживающее лечение, как описано выше. Для стимуляции восстановления числа нормальных лейкоцитов после подавления функции костного мозга на фоне химиотерапии вводятся гормоны, контролирующие продукцию лейкоцитов в костном мозге, такие как гранулоцитарный колониестимулирующий фактор (ГКСФ). К сожалению, это не дает полного решения проблемы снижения числа лейкоцитов после химиотерапии, так как ГКСФ стимулирует рост и размножение детерминированных миелоидных стволовых клеток, а не примитивных клеток, которые выживают после химиотерапии и становятся основой для репопуляции костного мозга.
Мукозит. Все быстро делящиеся клетки тканей организма поражаются химиотерапией, а клетки слизистой желудочно-кишечного тракта именно такими и являются. У пациентов на фоне химиотерапии часто возникают язвы на слизистой рта и диарея, что может потребовать внутривенного питания, если прием пищи становится проблемой.
Фертильность. Цитотоксические препараты являются тератогенными веществами, то есть они могут вызывать пороки развития у плода. Поэтому больные, получающие химиотерапию, должны предпринимать адекватные противозачаточные меры. Кроме того, эти препараты, в зависимости от типа и дозы, могут вызывать бесплодие временное или постоянное. Выходом из этой ситуации для мужчины может быть забор спермы до химиотерапии и ее хранение. Что касается женщин, то технология успешного замораживания и оттаивания неоплодотворенных яйцеклеток пока далека от идеала.
Тело человека. Снаружи и внутри. №4 2008